MINI SZEMLE
A rák elleni előőrs: univerzális csak rákjelzők
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Kína;2 Általános Sebészeti Osztály, a Harbini Orvostudományi Egyetem első társkórháza, Harbin 150001, Kína;3Shandong Epiprobe Medical Laboratory Co., Ltd., Heze 274108, Kína;4 Ningxia Hui Autonóm Régió Népi Kórháza, Ningxia Orvosi Egyetem, Yinchuan 750002, Kína;5Sanghaji Közegészségügyi Klinikai Központ és Általános Sebészeti Osztály, Huashan Kórház és Rák Metasztázis Intézet és RNS Epigenetikai Laboratórium, Orvosbiológiai Tudományok Intézete, Shanghai Medical College, Fudan University, Shanghai 200032, Kína
ABSZTRAKT
A rák a vezető halálok világszerte.A rák korai felismerése csökkentheti a rák összes típusának halálozását;azonban a legtöbb ráktípus esetében hiányoznak a hatékony korai felismerhető biomarkerek.A DNS-metiláció mindig is az érdeklődés egyik fő célpontja volt, mivel a DNS-metiláció általában más kimutatható genetikai változások előtt megy végbe.Miközben a rák közös jellemzőit egy új, a DNS-metilációhoz szükséges pozícionáló szekvenálás segítségével vizsgálták, egy sor univerzális csak rákmarker (UCOM) erős jelöltként jelent meg a rák hatékony és pontos korai felismerésében.Míg a jelenlegi rákbiomarkerek klinikai értékét csökkenti az alacsony érzékenység és/vagy alacsony specificitás, az UCOM-ok egyedi jellemzői klinikailag jelentős eredményeket biztosítanak.Az UCOM-ok klinikai potenciáljának validálása tüdő-, méhnyak-, méhnyálkahártya- és urothelrákban tovább támogatja az UCOM-ok alkalmazását többféle ráktípusban és különböző klinikai forgatókönyvekben.Valójában az UCOM-ok alkalmazásai jelenleg aktív vizsgálat alatt állnak, további értékelésekkel a rák korai felismerésében, a kiegészítő diagnosztikában, a kezelés hatékonyságában és a kiújulás monitorozásában.A következő fontos kutatási témák azok a molekuláris mechanizmusok, amelyekkel az UCOM-ok kimutatják a rákot.Az UCOM-ok valós forgatókönyvekben való alkalmazása is megvalósítást és finomítást igényel.
KULCSSZAVAK
rák kimutatása;rákszűrés;DNS-metiláció;rák epigenetika;rák biomarkerek
Miért van szükségünk sürgősen újra biomarkerek?
A rákkal szembeni több mint egy évszázados küzdelem után a rák még mindig a leghalálosabb biológiai fenyegetés az emberiség számára.A rák továbbra is globális egészségügyi probléma, 2020-ban 19,3 millió új esetet és közel 10 millió halálesetet becsülnek1. 2020-ban becslések szerint 4,6 millió új rákos esetet diagnosztizáltak Kínában, ami a GLOBOCAN1 szerint az új rákos megbetegedések 23,7%-át teszi ki.Ezenkívül Kínában 2020-ban hozzávetőleg 3 millió halálesetet tulajdonítottak ráknak, ami a globális rákkal összefüggő halálesetek 30%-a1.Ezek a statisztikák azt mutatják, hogy Kína az első helyen áll a rák előfordulási és halálozási arányában.Ráadásul a rák 5 éves túlélési aránya 40,5%, ami 1,5-szer alacsonyabb, mint az Egyesült Államok 5 éves túlélési aránya2,3.A viszonylag alacsonyabb túlélési és magasabb halálozási arány Kínában, mint a magasabb humán fejlettségi indexű országokban, arra utal, hogy sürgősen szükség van egy hatékony és költséghatékony rákmegelőzési és -felügyeleti rendszerre.A rák korai felismerése az egyik legkritikusabb elem az egészségügyi rendszerben.A rák korai felismerése szinte minden ráktípusnál javíthatja a prognózist és a túlélést korai stádiumban4.A sikeres szűrési stratégiák a méhnyak-, emlő-, vastagbél- és prosztatarák incidenciájának és halálozási arányának jelentős csökkenéséhez vezettek.
A rák korai felismerése azonban nem könnyű feladat.A folyamat legnagyobb akadályát mindig is a korai rák biológiájának és prognózisának vizsgálata, a megbízható korai felismerési biomarkerek azonosítása és validálása, valamint a hozzáférhető és pontos korai felismerési technológiák fejlesztése jelentette4.A rák pontos felismerése megkülönböztetheti a jóindulatú és rosszindulatú elváltozásokat, ami segít elkerülni a szükségtelen eljárásokat, és megkönnyíti a betegség további kezelését.A jelenlegi korai felismerési stratégiák magukban foglalják az endoszkóp alapú biopsziákat, az orvosi képalkotást, a citológiát, az immunológiai vizsgálatokat és a biomarker teszteket5-7.Mivel tolakodóak és költségesek, az endoszkóp alapú biopsziák eredendően súlyos terhet jelentenek, mint a professzionális személyzetre támaszkodó jelentős orvosi eljárás.A citológiához hasonlóan mindkét szűrési módszer az egészségügyi szakemberektől függ, és személyes ítéleten alapul, és a teljesítmény messze nem ideális8.Ezzel szemben az immunológiai vizsgálatok nagyon pontatlanok, tekintettel a magas hamis pozitív arányra.Az orvosi képalkotás, mint szűrési taktika, drága berendezéseket és speciális technikusokat igényel.Ezért az orvosi képalkotás rendkívül korlátozott az alacsony hozzáférhetőség miatt.Mindezen okok miatt a biomarkerek jobb megoldásnak tűnnek a rák korai felismerésére.
Levelezés: Yinshan Li és Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID azonosító: https://orcid.org/0009-0005-3340-6802 és
https://orcid.org/0000-0001-9920-1133
2023. augusztus 22-én érkezett;elfogadva 2023. október 12-én;
online közzététel: 2023. november 28.
Elérhető a www.cancerbiomed.org oldalon
©2023 Rákbiológia és orvostudomány.Creative Commons
Nevezd meg – nem kereskedelmi célú 4.0 nemzetközi licenc
A biomarkereket jelenleg fehérjék, DNS-mutációs markerek, epigenetikai markerek, kromoszóma-rendellenességek, közvetlenül daganatokból származó RNS-markerek vagy testnedvekből közvetve nyert tumorfragmensek kategóriába sorolják.A fehérjemarkerek a legszélesebb körben alkalmazott biomarkerek a rákszűrésben és -diagnosztikában.A fehérje biomarkereket, mint szűrési biomarkereket korlátozza a jóindulatú elváltozásokra való hajlam, ami túldiagnosztizáláshoz és túlkezeléshez vezet, amint azt az α-fetoprotein és a prosztataspecifikus antigén (PSA) esetében is beszámolták9,10.Az RNS-markerek közé tartoznak a genetikai expressziós mintázatok és más nem kódoló RNS-markerek. A genetikai expressziós RNS-markerek kombinációja kimutatható vizeletminták segítségével, amelyek érzékenysége messze nem volt kielégítő (60%) primer daganatok esetén, és amelyek kimutatása befolyásolhatja az RNS könnyen lebomló természete a normál környezetben11.A genetikai és epigenetikai markerek egyaránt szembesülnek a daganatok előfordulásának problémájával és a ráktípusokra való korlátozással.
A DNS-metiláció erős jelölt a korai felismerés biomarkereként, amióta Feinberg 1983-ban először összekapcsolta a rákkal12. A DNS-metilációs rendellenességek a rák minden stádiumában megfigyelhetők, már a rákmegelőző stádiumban is.Az aberráns DNS-hipermetiláció általában a génpromoterek CpG-szigetein megy végbe, hogy ellensúlyozza a tumorszuppresszorokat13,14.A tanulmányok arra is utaltak, hogy az abnormális DNS-hipermetiláció szerepet játszik a fejlődési szabályozók felszabályozásában15.A DNS-metilációs völgy, amelyet általában a fejlődési szabályozókkal és a hipermetilált rákkal társítanak, átválthatja a génexpressziós módot egy stabilabb DNS-metiláció-függő módra, és csökkentheti a metilált H3K27me3 hisztonhoz és a kapcsolódó polikomba-fehérjékhez való kapcsolódást16,17.
A nagyszámú publikált DNS-metilációs marker közül több sikeresen debütált a piacon;A jelenleg kereskedelmi forgalomba hozott DNS-metilációs markerek és diagnosztikai panelek azonban számos okból még nem tárták fel teljesen a rák korai felismerésének lehetőségét18.Bár többnyire elfogadható teljesítményt mutatnak az adatbázis-információk felhasználásával, ezek a biomarkerek általában kevésbé ideálisan teljesítenek a valós világban, mivel a valós minták gyakran összetettebbek és nem olyan reprezentatívak, mint az adatbázisokban kiválasztottak.A következő generációs szekvenáláson alapuló többrákos metiláció korai felismerése csupán 16,8%-os és 40,4%-os érzékenységet mutat az I. és II. stádiumú rákban19.A korai felismerési tesztek nagyobb stabilitást és pontosabb biomarkereket igényelnek.
Univerzális csak rákmarker (UCOM) felfedezése útmutató helymeghatározó szekvencia (GPS) segítségével
A több évtizedes rákkutatás ellenére kielégítő megelőzés és kezelés nem valósult meg.Új módszerekre van szükség ahhoz, hogy a kutatók alaposan ki tudják értékelni a rákot.Az elmúlt 23 év során 6 rákos jellemzőt, például az apoptózis elkerülését, a szöveti inváziót és a metasztázisokat stb., 14-re bővítették olyan funkciókkal, mint a nemmutációs epigenetikai átprogramozás és a polimorf mikrobiomok20,21.Ahogy a rákkal kapcsolatos további részletek kerülnek napvilágra, egyre több perspektívát vezetnek be a rákkutatásba.A rákkutatás két irányban (közösség és egyéniség) fokozatosan új korszakba lépett.A precíziós onkológia elmúlt évekbeli fejlődésével a rákkutatás fókuszában az egyénre szabott célzott terápia és a rák heterogenitása áll22.Így a közelmúltban azonosított rák biomarkerek főként specifikus ráktípusokra összpontosítottak, mint például a PAX6 méhnyakrákra23 és a BMP3-ra a vastag- és végbélrák esetében24.Ezeknek a ráktípusokra jellemző biomarkereknek a teljesítménye változó, de a biológiai mintavétel korlátozottsága és a magas költségek miatt még mindig nem lehetséges, hogy az arra fogékony egyének egyidejűleg minden rákos megbetegedésre szűrjenek.Ideális lenne, ha egyetlen, robusztus biomarkert tudnánk azonosítani, amely minden ráktípusra hatásos a korai stádiumban.
Egy ilyen ideális cél eléréséhez jobb biomarker jelöltet kell kiválasztani a lehetséges biomarker típusok listájából.A DNS-metilációs aberrációk az összes genetikai és epigenetikai profil közül köztudottan összefüggenek a rákkal, és a legkorábbi, ha nem az első, a rákkal kapcsolatos rendellenességek közé tartoznak, amelyek időrendi sorrendben fordulnak elő.A DNS-metiláció vizsgálata korán elkezdődött, de a kutatási módszerek hiánya hátráltatta.A genom 28 millió potenciális metilált CpG helye közül egy kezelhető számot kell kimutatni, és a genomhoz igazítani, hogy jobban megértsük a tumorigenezist.A teljes genom hidrogén-szulfit szekvenálása (WGBS), amelyet a DNS-metilációs szekvenálás aranystandardjának tartanak, a rákos sejtekben a Cs-nek csak 50%-át képes lefedni a hidrogén-szulfit-kezelés természetéből adódóan, amely széttöri a DNS-fragmenseket és csökkenti a genom komplexitását a folyamat során. a Cs-Ts25 átalakulása.Más módszerek, mint például a 450 ezer chip, a genom metilációjának csak 1,6%-át fedik le.450 000 adat alapján egy DNS-metilációt észlelő panel 35,4%-os érzékenységgel rendelkezik az I. stádiumú rák 6 típusára26.A ráktípusok korlátai, a gyenge teljesítmény és az analitikai folyamatban a kimutatási módszerek által keltett zaj váltak a pánrák-detektáló panelek legnagyobb akadályává.
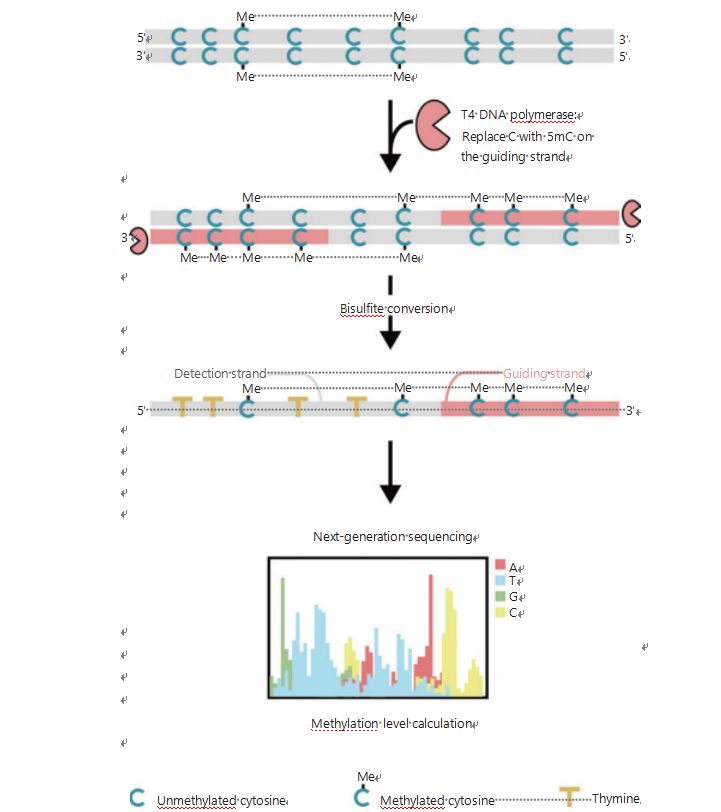
A sejtek epigenetikai mintázatainak jobb vizsgálata érdekében a tumorigenezis és a metasztázis során kifejlesztettünk egy egyedülálló GPS-t a genomszintű DNS-metiláció kimutatására, amely lefedi a CpG helyek akár 96%-át 0,4 milliárd leolvasás során25.A GPS egy kétoldali szekvenálási módszer, amely nem konvertálható metil-citozinok DNS-fragmensének 3'-végét használó hidrogén-szulfit-kezelést követően, és ez irányítja az 5'-vég DNS-metilációjának kiszámítását a pár-vég szekvenáláson keresztül (1. ábra)25.A templátszálként működő metil-citozin vezető szál segíti a magas GC-szintű régiók összehangolását, amely visszanyeri a hagyományos WGBS-ben leginkább elhagyott szekvenálási adatokat.A GPS nagy lefedettsége hatalmas mennyiségű DNS-metilációs információt biztosít, ami lehetővé teszi a rák metilációs profiljának lényegesen nagyobb felbontású vizsgálatát a korábban alulvizsgált régiókban.
A GPS hatékony eszközt biztosít számunkra a rák homogenitásának vizsgálatához, amely nagymértékben leegyszerűsítheti a rákkutatást, és potenciálisan univerzális magyarázatot találhat a daganatképződésre és az áttétekre.A rákos sejtvonalak GPS-adatainak elemzése során gyakran találkoztak egy egyedi jelenséggel.Számos olyan régió volt, amely abnormálisan hipermetiláltnak tűnt többféle rákmintában.Ezt a váratlan megállapítást később UCOM-ként is érvényesítették.A The Cancer Genome Atlas (TCGA) adatbázisban található 17 ráktípusból több mint 7000 mintát elemeztek, amelyek között azonosítottuk az első UCOM-ot, a HIST1H4F-et, egy hisztonhoz kapcsolódó gént, amely minden ráktípusban hipermetilált27.Ezután egy sor UCOM-ot találtak és validáltak a TCGA adatbázisban, a Gene Expression Omnibus (GEO) adatbázisban és a valós klinikai mintákban.Jelenleg a HIST1H4F, a PCDHGB7 és a SIX6 UCOM-ként találták meg és érvényesítették.Az UCOM-ok váratlan felfedezése hatékony választ kínál a rák korai felismerésének szükségességére.Az UCOM-ok megoldást kínálnak több rák egyetlen markeres kimutatására.
Az UCOM-ok jellemzői
A validálás során az UCOM-okról kiderült, hogy négy olyan fő jellemzőt mutatnak, amelyek lehetővé teszik az UCOM-ok számára, hogy felülmúlják a jelenlegi biomarkerek hatékonyságát (2. ábra).
Egyedülálló a rosszindulatú daganatokra
Az UCOM-ok kizárólag a rákos vagy rákelőtti elváltozásokra jellemzőek, és nem befolyásolják a normál fiziológiai változások.Néhány jelenlegi rákkal kapcsolatos marker, amelyet széles körben alkalmaznak a korai felismerésben és/vagy szűrésben, túldiagnosztizáláshoz vezetett.Emelkedett PSA-szintet, egy klinikailag akkreditált szűrőeszközt, jóindulatú állapotokban is kimutatnak, például prosztata hiperpláziában és prosztatagyulladásban10.A túldiagnózis és az ebből eredő túlkezelés az életminőség romlásához vezet bélrendszeri, vizeletürítési és szexuális szövődmények miatt28.Más fehérjealapú és a klinikai környezetben széles körben használt biomarkerek, mint például a CA-125, nem jártak jelentős előnyökkel, miközben túldiagnózist és túlkezelést igényeltek29.Az UCOM-ok rosszindulatú daganatokra való nagy specifitása elkerüli ezeket a hiányosságokat.Az UCOM, PCDHGB7, hatékonyan különbözteti meg a magas fokú laphámrákot (HSIL) és a méhnyakrákot a normál mintáktól és az alacsony fokú laphám intraepiteliális lézióktól (LSIL), míg a legtöbb más biomarker csak a méhnyakrákot képes megkülönböztetni a normál mintáktól30.Bár a PCDHGB7 nem mutat ki szignifikáns különbséget a normál endometrium és az endometrium hiperplázia között, szignifikáns különbségek észlelhetők a normál endometrium és az atípusos hiperplázia között, és még nagyobb különbségek mutatkoznak a normál endometrium és az endometriumrák (EC) között a PCDHGB731 alapján.Az UCOM-ok egyedülállóak az adatbázisokban és a klinikai mintákban található rosszindulatú elváltozások esetében.A páciens szempontjából az egyedi UCOM-ok csökkentik a különböző rosszul teljesítő instabil biomarkerek komplex indikációinak megértésének küszöbét és a megfelelő szorongást az értékelési folyamat során.A klinikus szemszögéből az egyedi UCOM-ok megkülönböztetik a rosszindulatú daganatokat a jóindulatú elváltozásoktól, ami segíti a betegek osztályozását, és csökkenti a szükségtelen orvosi eljárások és túlkezelések számát.Ezért az egyedi UCOM-ok csökkentik az egészségügyi rendszer redundanciáját, enyhítik a rendszer szorongását, és több egészségügyi erőforrást tesznek elérhetővé a rászorulók számára.
1. ábra A GPS-munkafolyamat vázlata a DNS-metiláció detektálásához25.Szürke vonal: bemeneti DNS-szekvencia;piros vonal: T4 DNS-polimerázzal kezelt DNS, amely a citozint 5′-metilcitozinnal helyettesíti a bemenet 3′ végén;kék C Me: metilált citozin;kék C: nem metilált citozin;sárga T: timin25.
Mindent vagy semmit
Az UCOM-ok csak a rákos sejtekben vannak jelen, és szinte minden rákos sejtben stabilan kimutathatók.A HIST1H4F szinte minden daganattípusban hipermetiláltnak bizonyult, de normál mintákban nem27.Hasonlóképpen, a PCDHGB7 és a SIX6 is hipermetiláltnak bizonyult minden tumormintában, de nem a normál mintákban30-32.Ez az egyedi jellemző jelentősen javítja az UCOM-ok teljesítményét az észlelési és érzékenységi határok tekintetében.A rákos sejtek mindössze 2%-a differenciálható a mintákban, így az UCOM-ok sokkal érzékenyebb biomarkerek, mint a legtöbb létező biomarker30. A vastag- és végbélrák kimutatására használt biomarkerként a KRAS-mutációk csak a vastag- és végbélrák eseteinek körülbelül 36%-ában fordulnak elő. gyenge diagnosztikai potenciálra utal33.A KRAS-mutációk alacsony prevalenciája vastag- és végbélrákban korlátozza a KRAS-t más biomarkerekkel kombinálva.Valójában a biomarkerek kombinációja kezdetben ígéretesnek tűnhet, de nem mindig ad kielégítő eredményt, miközben sokkal nagyobb zajt mutat a detektálási elemzés során, és általában bonyolultabb kísérleti eljárásokat foglal magában.Ezzel szemben a PCDHGB7 és más UCOM-ok minden rákban megtalálhatók.Az UCOM-ok a lehető legnagyobb pontossággal detektálják a rákos összetevőket különböző típusú rákmintákban, miközben felszámolják az összetett zajszűrő elemzési folyamatokat.Nem nehéz kimutatni a rákot bőséges mintában, de rendkívül nehéz a rákot kimutatni kis mintában.Az UCOM-ok kis mennyiségű rákot képesek kimutatni.
2. ábra Az UCOM-ok jellemzői.
A rák kimutatása a kóros elváltozásokat megelőzően
Az UCOM-ok a rák előtti szakaszban kimutathatók a kóros elváltozások előtt.Mint epigenetikai biomarkerek, az UCOM-rendellenességek korábbi stádiumban fordulnak elő, mint a fenotípusos rendellenességek, és a tumorigenezis, progresszió és metasztázis során kimutathatók34,35.Az UCOM érzékenysége idővel növeli az UCOM teljesítményét a korai stádiumú rák és a rák előtti elváltozások kimutatásában.A rák korai felismerése biopsziák és citológia alapján még a legtapasztaltabb patológusok számára is nehéz lehet.A kolposzkópiával nyert egyetlen biopszia a HSIL+ minták 60,6%-ánál pozitívnak bizonyult.Többszörös elváltozás esetén további biopsziák szükségesek az érzékenység növelése érdekében36.Ezzel szemben az UCOM, PCDHGB7, 82%-os érzékenységgel rendelkezik a HSIL+ mintákra, ami meghaladja a biopsziák és a legtöbb biomarker érzékenységét30.A metilációs marker, a FAM19A4, 69%-os érzékenységgel rendelkezik CIN2+-ra, ami hasonló a citológiához, de nem tudja megkülönböztetni a CIN1-et a normál mintáktól37.Az UCOM-okról kimutatták, hogy sokkal érzékenyebb korai felismerési biomarkerek.A tapasztalaton alapuló patológusokhoz képest az UCOM-ok jobb észlelési érzékenységgel rendelkeznek a korai stádiumú rákos megbetegedések esetében, ami viszont hozzájárul a rák prognózisának és túlélésének javulásához30.Ezenkívül az UCOM-ok olyan észlelési platformot kínálnak, amely elérhető olyan területeken, ahol nincsenek tapasztalt patológusok, és nagymértékben javítja az észlelés hatékonyságát.Az egységes mintavételi és észlelési eljárásokkal az UCOM-detektálás stabil és könnyen értelmezhető eredményeket ad, amelyek jobban megfelelnek a kevesebb szakembert és orvosi erőforrást igénylő szűrési protokollnak.
Könnyen felismerhető
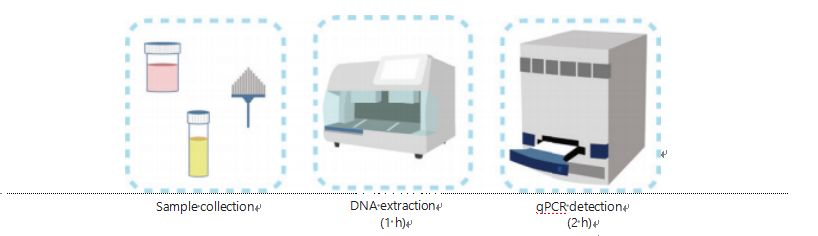
A DNS-metiláció kimutatásának jelenlegi módszerei bonyolultak és időigényesek.A legtöbb módszer biszulfit-átalakítást igényel, ami a minta minőségének romlását okozza, és esetleg instabil és pontatlan eredményeket ad.A biszulfit-kezelés által okozott rossz reprodukálhatóság zavart okozhat az orvosokban és a betegekben, és tovább zavarja a nyomon követési és/vagy kezelési stratégiákat.Ezért tovább módosítottuk az UCOM kimutatás módszerét, hogy elkerüljük a minták problémás biszulfitos kezelését, megfeleljünk a klinikai alkalmazási követelményeknek, és javítsuk a hozzáférhetőséget.Új módszert dolgoztunk ki metilációra érzékeny restrikciós enzimek és valós idejű fluoreszcens kvantitatív PCR (Me-qPCR) kombinálásával az UCOM-ok metilációs állapotának számszerűsítésére 3 órán belül, könnyen kezelhető eljárások segítségével (3. ábra).A Me-qPCR többféle mintatípust is képes kezelni, mint például a testfolyadékok klinikai gyűjtése és a saját maga által gyűjtött vizeletminták.Az összegyűjtött klinikai minták feldolgozhatók, tárolhatók, és standardizált és automatizált DNS-kivonás segítségével könnyen detektálhatók.Az extrahált DNS ezután közvetlenül felvihető a Me-qPCR platformra az egyedényes reakció és a kimeneti kvantifikációs eredmények érdekében.Az egyes ráktípusokra illesztett és validált diagnosztikai modellekkel végzett egyszerű eredményelemzést követően az UCOM kimutatási eredmények végső meghatározását félkvantitatív értékként értelmezzük és jelenítjük meg.Az EZ DNA Methylation-Gold kit protokollja szerint a Me-qPCR platform felülmúlja a hagyományos biszulfit-piroszekvenálást az UCOM detektálásban, miközben 3 órát takarít meg a biszulfit konverziótól.Az innovatív metilációészlelési platform stabilabbá, pontosabbá és hozzáférhetőbbé teszi az UCOM-felismerést30.
3. ábra UCOM-ok észlelési folyamata.A mintatípusok közé tartozik a professzionálisan vett BALF, Pap ecset és/vagy a saját maga által gyűjtött vizelet.A DNS-kivonási folyamat egy automatikus extraktorba illeszthető, amelynek terméke qPCR-rel közvetlenül detektálható.
UCOM-ok alkalmazása
Tüdőrák
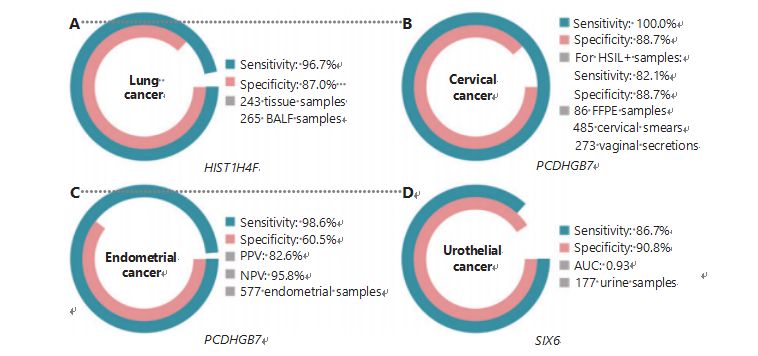
A tüdőrák a második leggyakrabban diagnosztizált és leghalálosabb rák világszerte, az új esetek 11,4%-áért és az új halálozások 18,0%-áért1.A diagnózisok 85%-a nem-kissejtes tüdőrák (NSCLC), 15%-a pedig kissejtes tüdőrák (SCLC), amelynek magasabb a rosszindulatú daganata38.Az alacsony dózisú komputertomográfiás (LDCT) szkennelés a jelenleg javasolt tüdőrák szűrési módszer, amelyről kimutatták, hogy javítja a korai felismerést és csökkenti a mortalitást6;azonban az alacsony specificitás és a rossz hozzáférhetőség miatt az LDCT még nem szolgált kielégítő szűrési módszerként, csakúgy, mint más gyakori rákmarkerek, mint például a CEA39.Az LDCT-szűrési stratégia költségei és a kihagyott diagnózisok és téves diagnózisok lehetősége akadályozza a tüdőrák-szűrés népszerűsítését40.A HIST1H4F, egy UCOM, óriási potenciállal rendelkezik, mint korai kimutatási biomarker a bronchoalveoláris folyadék (BALF) mintákban27.A HIST1H4F hipermetilált tüdőadenokarcinómában és tüdőlaphámsejtes karcinómában, kimutatási specificitása 96,7%, szenzitivitása 87,0% (4A ábra), és kivételes teljesítménnyel I. stádiumú rákos megbetegedések esetén27.A HIST1H4F specificitása 96,5%, szenzitivitása 85,4% NSCLC esetén, illetve 96,5% és 95,7% SCLC27 esetén.Ezenkívül nyolc másik ráktípusból, köztük a hasnyálmirigy- és vastagbélrákból származó minták igazolták, hogy a HIST1H4F mind a nyolc típusban hipermetilált27.
Méhnyakrák
2020-ban a méhnyakrák volt a negyedik leggyakrabban diagnosztizált rák és a negyedik vezető halálok a nők körében, ami az új esetek 3,1%-át és a rákkal összefüggő halálozások 3,4%-át tette ki világszerte1.A méhnyakrák 2030-ra történő megszüntetéséhez a WHO javaslata szerint a méhnyakrák korai felismerése elengedhetetlen.Ha korai stádiumban észlelik, az 5 éves túlélési arány eléri a 92%-ot invazív méhnyakrák esetén41.Az American Cancer Society (ACS) irányelvei cervicalis citológiai teszteket, elsődleges HPV-teszteket vagy szűrési segédleteket javasolnak42.A cervicalis citológia invazív, és csak a CIN2+ esetek 63,5%-át képes kimutatni37.
Ezzel szemben a PCDHGB7 sokkal jobban teljesített Pap-kenet és hüvelyváladék használatával, és hatékonyan képes megkülönböztetni a HSIL-t az LSIL-től a rendkívül korai stádiumban.A PCDHGB7 önmagában 100,0%-os szenzitivitása és 88,7%-os specificitása a méhnyakrák esetében (4B. ábra), a HSIL+ minták esetében pedig 82,1%-os és 88,7%-os specificitása30.A PCDHGB7 90,9%-os szenzitivitással és 90,4%-os specificitással rendelkezik a méhnyakrák esetében sokkal könnyebben összegyűjthető hüvelyváladék-mintákban30.A magas kockázatú (hr) HPV teszttel vagy a Thinprep citológiai teszttel (TCT) kombinálva a PCDHGB7 érzékenysége 95,7%-kal, specificitása pedig 96,2%-kal nőtt, ami jelentősen meghaladja a hrHPV teszt (20,3%), TCT (51,2%) értékét. ), és a kettő együtt (57,8%) a méhnyakrák esetében30.A PCDHGB7 a TCGA-adatbázisból 17 ráktípusban hipermetiláltnak bizonyult, ami azt jelzi, hogy alkalmas az UCOM családban30.
4. ábra Az UCOM-okat négy ráktípusban validálták nagyszabású klinikai vizsgálatok során.A. A HIST1H4F, egy UCOM teljesítménye 508 minta tüdőrák kimutatásában.B. A PCDHGB7, egy UCOM teljesítménye 844 minta méhnyakrák kimutatásában.C. A PCDHGB7, egy UCOM teljesítménye 577 méhnyálkahártya Pap és Tao ecsetminta méhnyálkahártyarák kimutatásában.D. A SIX6, egy UCOM teljesítménye 177 minta uroteliális rák kimutatásában.
EC
Az EK az egyik leggyakoribb női reproduktív rendszer daganatos megbetegedése világszerte, évente 4,2 millió új esettel és a rákkal összefüggő halálozások 1%-ával1.A korai stádiumban történő sikeres diagnózissal az EC gyógyítható, és az 5 éves túlélési arány 95% az I. stádiumú rák esetében.Az olyan tünetekkel járó betegek, mint például a kóros méhvérzés, időszakos klinikai értékelésben részesülnek, és invazív és fájdalmas biopsziás eljárásokon esnek át, annak ellenére, hogy végül csak 5–10%-uknál alakul ki EC43.A transzvaginális ultrahang, mint az elterjedt kimutatási módszer, nagyon megbízhatatlan, mivel nem képes megkülönböztetni a jóindulatú és rosszindulatú endometrium elváltozásokat, valamint a magas hamis pozitív arány44.
Párhuzamosan összehasonlították a CA-125 szérumot, amely egy széles körben alkalmazott EC biomarker, és a PCDHGB7-et.A CA-125 szérum érzékenysége 24,8%-os volt, ami arra utal, hogy a CA-125 nem megfelelő marker az EC-hez a 92,3%-os specificitás ellenére31.A PCDHGB7 kimutatása Pap ecset mintákkal 80,65%-os szenzitivitást és 82,81%-os specificitást eredményezett az ECatall stádiumokban, míg a Tao ecset érzékenysége 61,29%, specificitása pedig 95,31%31.A Me-qPCR-en alapuló PCDHGB7 diagnosztikai modell 98,61%-os érzékenységet, 60,5%-os specificitást és 85,5%-os általános pontosságot eredményezett Pap és Tao ecsetminták használatával (4C. ábra)31.
Urotheliális rák
A húgyhólyag-, vesemedence- és húgycsőrákból álló urothelrák volt a hetedik leggyakrabban diagnosztizált rák 2020-ban világszerte, az új esetek 5,2%-át és a halálozások 3,9%-át1.Az urothelrákok, amelyeknek több mint 50%-a hólyagrák, 2022-ben a negyedik leggyakrabban diagnosztizált rák volt az Egyesült Államokban, ami az újonnan diagnosztizált esetek 11,6%-át tette ki3.A húgyhólyagrákok körülbelül 75%-a nem izom-invazív hólyagráknak minősül, amely a nyálkahártyára vagy a nyálkahártya alatti rákra korlátozódik45.A cisztoszkópiás biopszia az uroteliális rák diagnosztizálásának aranystandardja, amelyet fluoreszcens in situ hibridizációval (FISH) és citológiai tesztekkel hajtanak végre.A FISH és a citológia gyenge diagnosztikai teljesítményt nyújt, a cisztoszkópia pedig intruzív, és fennáll annak a kockázata, hogy hiányoznak a mikroléziók, félreértelmezik a léziókat, és potenciálisan a rák terjedését vagy visszaesését idézik elő46.A korábban validált UCOM-ról, a PCDHGB7-ről is kimutatták, hogy uroteliális rákban hipermetilált, a görbe alatti terület 0,86, ami potenciális diagnosztikai képességre utal30.Több UCOM további validálása és több mintatípus jobb befogadása érdekében megvizsgálták a SIX6-ot, egy új UCOM-ot, amely kiváló diagnosztikai potenciált mutatott az urothelrák korai felismerésében a Me-qPCR platformon lévő vizeletminták felhasználásával.A vizeletminták felhasználásával végzett SIX6 kimutatás 86,7%-os kompetitív szenzitivitást és 90,8%-os specificitást mutatott (4D. ábra), ugyanakkor nem invazív és könnyen megszerezhető32.A SIX6 potenciálját a metasztázis monitorozásában és a kezelés hatékonyságának értékelésében jelenleg vizsgálják.
A jövő és a kihívások
Az UCOM-ok erős teljesítményt nyújtanak a többszörös rákos megbetegedések diagnosztikájában, de még sok a tennivaló.Bővítettük az UCOM-ok listáját, és aktívan validáltuk az UCOM-okat több ráktípusban, beleértve azokat is, amelyeket hagyományosan nehéz kimutatni.A TCGA adatbázisokból származó validálási eredmények tovább erősítették az UCOM-ok alkalmazását több ráktípusban és több helyzetben.Egy előzetes vizsgálat során az UCOM-okról kimutatták, hogy erőteljes diagnosztikai potenciállal rendelkeznek a kolangiokarcinómák és a hasnyálmirigy-adenokarcinómák tekintetében, amelyeket a jelenlegi szűrési módszerekkel szinte lehetetlen korai szakaszban diagnosztizálni32,47.A ritka rákos megbetegedések UCOM-okkal történő kimutatásának képessége a keringő tumor-DNS-sel (ctDNS) hasznosítható egy továbbfejlesztett folyékony biopsziás platformon48.Egy plazma-DNS-alapú pánrák-detektáló panelt magában foglaló vizsgálat 57,9%-os érzékenységet eredményezett49.A magas specifikusság ellenére az általános teljesítmény azt mutatja, hogy van még mit javítani.
Az UCOM-ok egyedi jellemzői szintén támogatták az UCOM-potenciál vizsgálatát a kezelés hatékonyságának értékelésében és a kiújulás monitorozásában.A Response Evaluation Criteria in Solid Tumors (RECIST) szerint az orvosi képalkotás az ajánlott módszer a kiújulás megfigyelésére és a kezelés hatékonyságának értékelésére, míg a tumormarkereket önmagában használják az értékeléshez50.A valóságban azonban a képalkotó módszereket nagymértékben befolyásolja a gyakoriság és az időzítés, ezért nagyobb kockázatnak és költségeknek teszik ki a betegeket51,52.A SIX6-ot validálták az emlőrák metasztázisainak előrejelzőjeként32.A folyékony biopszián alapuló ctDNS-monitorozás valós idejű megfigyelést tesz lehetővé minimális maradék betegség hónapokkal a radiológiai kimutatás előtt, ideális esetben késlelteti és megelőzi a visszaeséssel összefüggő rák progresszióját53.Az előzetes eredmények arra utalnak, hogy az UCOM-ok valós időben tükrözik a rákos hipermetiláció szintjét közvetlenül a műtét és a kezelés után32.Az UCOM-ok által mutatott nagy érzékenység és a több nem intruzív mintatípusban való alkalmazhatóság lehetővé teszi, hogy az UCOM-ok precíz kiújulás-monitorozó biomarkerként szolgáljanak, miközben fenntartják a betegek magas szintű együttműködését.
Ugyanakkor a teszt nyilvános hozzáférhetősége egy másik fontos kérdés, amely további erőfeszítéseket igényel.Míg az UCOM-felderítési együttműködést több kórházban alkalmazták annak reményében, hogy több beteg számára előnyösek, addig Kínában aktívan végeznek pro bono kimutatásokat és szűréseket.Az UCOM-ok jobb hozzáférhetőséget igényelnek, hogy megvalósítható szűrési eszköznek minősüljenek, különösen az elmaradott területeken.
Míg az UCOM-alkalmazás korai felismerése ígéretes, az UCOM-mal kapcsolatban sok ismeretlen létezik.Aktív feltárással további kutatások szükségesek arra vonatkozóan, hogy az UCOM-ok miért vannak általánosan jelen a rákos megbetegedésekben.Az UCOM-ok mögött meghúzódó epigenetikai szabályozási mechanizmusok további vizsgálatot érdemelnek, ami indokolhatja a rákterápia új irányvonalát.Visszatérve a tumor homogenitása és heterogenitása közötti kölcsönhatásra, az érdekel minket, hogy az UCOM-ok miért lehetnek kivételek a rák biomarkereinek többsége alól, amelyek szorosan kapcsolódnak bizonyos ráktípusokhoz.Az UCOM által azonosított DNS-metilációs aberrációk szerepe a daganatképződésben, a tumor progressziójában és a metasztázisban nem tisztázott a sejtazonosság elvesztésének és visszanyerésének folyamatában, és alapos vizsgálatot tesz szükségessé.Egy másik jelentős érdeklődés az UCOM-ok homogenitási tulajdonságának szövet-egyedi markerekkel való beépítése, annak reményében, hogy a ráknyomok precíz kimutatását és a tumorszövet eredetének fordított módon történő azonosítását lehet elérni.Az UCOM-ok ideális eszközei lehetnek a rák megelőzésében, a rák kimutatásában, és potenciálisan megvédhetik és megszüntethetik a rákot.
Támogatás nyújtása
Ezt a munkát a Kínai Nemzeti Kulcsfontosságú K+F Program (2022BEG01003 támogatás), a Kínai Nemzeti Természettudományi Alapítvány (32270645. és 32000505. sz. támogatás), a Heilongjiang Tartományi Egészségügyi Bizottságtól kapott támogatás (2020-111. sz. támogatás) támogatta. , valamint a Heze Tudományos és Technológiai Intézettől kapott támogatás (2021KJPT07 sz. támogatás).
Összeférhetetlenségi nyilatkozat
Wei Li a Shanghai Epiprobe Biotechnology Co., Ltd. kutatás-fejlesztési igazgatója. Wenqiang Yu az Epiprobe Tudományos Tanácsadó Testületének tagja.W. Yu és az Epiprobe jóváhagyta a munkához kapcsolódó, függőben lévő szabadalmakat.Az összes többi szerző nem nyilatkozik egymással versengő érdekekről.
Szerzői hozzájárulások
A projekt ötlete és tervezése: Chengchen Qian és Wenqiang Yu.
Írta a dolgozatot: Chengchen Qian.
Az illusztrációkat készítette: Chengchen Qian.
Átnézte és szerkesztette a kéziratot: Xiaolong Zou, Wei Li, Yinshan Li és Wenqiang Yu.
Hivatkozások
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A és munkatársai.Globális rákstatisztika 2020: GLOBOCAN becslések
világszerte 185 országban 36 rákos megbetegedéssel kapcsolatos incidencia és mortalitás.CA Cancer J Clin.2021;71, 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S és mások.Rákstatisztikák Kínában és az Egyesült Államokban, 2022: profilok, trendek és meghatározó tényezők.Chin MedJ (angol).2022;135, 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Rákstatisztika, 2023. CA Cancer J Clin.2023;73, 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M és társai.A rák korai felismerése.Tudomány.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Stratégiák a
vastagbélrák szűrés.Gasztroenterológia.2020;158, 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Tüdőrák szűrés.Am J Respir Crit Care Med.2015;191, 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P és munkatársai.Az IARC perspektívája a méhnyakrák-szűrésről.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.A kolposzkópia kihívásai a méhnyakrák szűrésére az LMIC-ben és a mesterséges intelligencia általi megoldások.BMC Med.2020;18:169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Keringő biomarkerek a hepatocelluláris karcinóma diagnosztizálásában és kezelésében.Nat Rev Gastroenterol Hepatol.2022;19, 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. A prosztatarák szérum PSA-alapú korai felismerése Európában és globálisan: múlt, jelen és jövő.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
et al.Multiplex RNS vizeletvizsgálat kidolgozása átmeneti hólyagsejtes karcinóma kimutatására és rétegződésére.Clin Cancer Res.2008;14, 742-9 (1999)].
12. Feinberg AP, Vogelstein B. A hipometiláció megkülönbözteti egyes humán rákos megbetegedések génjeit normál megfelelőiktől.Természet.1983;301, 89-92.
13. Ng JM, Yu J. Promoter hypermethylation of tumor supressor gének, mint potenciális biomarkerek vastagbélrákban.IntJ Mol Sci.2015;16, 2472-96 (1996)].
14. Esteller M. Rák epigenomika: DNS-metilómok és hisztonmódosítási térképek.Nat Rev Genet.2007;8, 286-98.
15. Nishiyama A, Nakanishi M. Navigálás a rák DNS-metilációs táján.Trends Genet.2021;37, 1012-1027 (1999)].
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P és munkatársai.Humán embrionális őssejtek többvonalas differenciálódásának epigenomikus elemzése.Sejt.2013;153, 1134-1148.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X és társai.Az egész genomra kiterjedő elemzések feltárják a Polycomb szerepét a DNS-metilációs völgyek hipometilációjának elősegítésében.Genome Biol.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
et al.A DNS-metiláció elemzése rákban: a hely újralátogatása.Nat Rev Clin Oncol.2018;15, 459-66.
19. KleinEA, Richards D., Cohn A., TummalaM, Lapham R., Cosgrove D és munkatársai.Célzott, metiláción alapuló többrákos korai felismerési teszt klinikai validálása független validációs készlet segítségével.Ann Oncol.2021;32, 1167-1177.
20. Hanahan D, Weinberg RA.A rák jellemzői.Sejt.2000;100, 57-70.
21. Hanahan D. A rák jellemzői: új dimenziók.Cancer Discov.2022;12, 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Precíziós onkológia: ki, hogyan, mit, mikor és mikor nem?Am Soc Clin Oncol Educ Book.2017: 160-9.
23. Liu H, Meng X, Wang J. Realtime kvantitatív metiláció
PAX1 gén kimutatása méhnyakrákszűrésben.IntJ Gynecol Cancer.2020;30, 1488-1492.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP és társai.Multitargetstool DNS-teszt a vastag- és végbélrák szűrésére.N EnglJ Med.2014;370, 1287-1297.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S és mások.Vezető pozicionálás
A szekvenálás azonosítja az aberráns DNS-metilációs mintákat, amelyek megváltoztatják a sejtazonosságot és a tumor-immun megfigyelő hálózatokat.Genom
Res.2019;29, 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY és mások.Nem intruzív multirák kimutatás keringő sejtmentes DNS-metilációs szekvenálás (THUNDER) segítségével: fejlesztési és független validációs vizsgálatok.Ann Oncol.2023;34, 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B és mások.A hisztonnal rokon gének tüdőrákban hipermetiláltak és hipermetiláltak
A HIST1H4F pánrák biomarkerként szolgálhat.Cancer Res.2019;79, 6101-12 (1999)].
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, et al.A prosztata-specifikus antigénszűrés életminőségre gyakorolt hatásai.N EnglJ Med.2012;367, 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Clinical hatékonysága a rákszűrési biomarker tesztek önköltséges egészségügyi szolgáltatásként: szisztematikus áttekintés.Eur J Közegészségügy.2016;26, 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z és társai.
A hipermetilált PCDHGB7, mint univerzális csak rákmarker és alkalmazása a méhnyakrák korai szűrésében.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X és társai.Hipermetilált PCDHGB7 biomarkerként a méhnyálkahártya rák korai kimutatására endometrium ecsetmintákban és méhnyakkaparékban.Front Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F és mások.Közösen
exkluzív epigenetikai módosítás a SIX6-on hipermetilációval a rákmegelőző stádium és a metasztázisok megjelenésének nyomon követésére.Signal Transduct Target Ther.2022;7:208.
33. Huang L, Guo Z, Wang F, Fu L. KRAS mutáció: a nem gyógyszerestől a gyógyszeres kezelésig a rákban.Signal Transduct Target Ther.2021;6:386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE és mások.A p16 (INK4a) aberráns metilációja a tüdőrák korai eseménye, és potenciális biomarker a korai diagnózishoz.Proc Natl Acad Sci U SA.1998;95, 11891-6 (1998)].
35. Robertson KD.DNS-metiláció és emberi betegségek.Nat Rev Genet.2005;6, 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C és mtsai.Többszörös biopszia és a méhnyakrák prekurzorainak kimutatása kolposzkópiában.J Clin Oncol.2015;33, 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD és mtsai.A FAM19A4 metilezési elemzése
A méhnyakkaparásban lévő gén nagyon hatékony a méhnyak kimutatásában
karcinómák és előrehaladott CIN2/3 léziók.Cancer Prev Res (Phila).2014;7, 1251-1257.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Tüdőrák.Gerely.2021;398, 535-54.
39. Grunnet M, Sorensen JB.Karcinoembrionális antigén (CEA) mint tumormarker a tüdőrákban.Tüdőrák.2012;76, 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L és mások.Tüdőrákszűrés, 3.2018-as verzió, NCCN klinikai gyakorlati irányelvek az onkológiában.J Natl Compr Canc Netw.2018;16, 412-41.
41. American Cancer Society.Rák tények és számok.Atlanta, GA, USA: American Cancer Society;2023 [frissítve: 2023. március 1.;idézve 2023. augusztus 22.].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A és mtsai.Méhnyakrák-szűrés átlagos kockázatú egyének számára: 2020-as iránymutatás frissítése az Amerikai Rákszövetségtől.CA Cancer J Clin.2020;70, 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Az endometriumrák kockázatának és a menopauza utáni vérzésének kapcsolata nőknél: szisztematikus áttekintés és metaanalízis.JAMA Intern Med.2018;178, 1210-1222 (1999)].
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A és mtsai.A transzvaginális ultrahang szűrés érzékenysége
posztmenopauzás nők méhnyálkahártyarákja esetén: eset-kontroll vizsgálat az UKCTOCS kohorszban.Lancet Oncol.2011;12, 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ és mtsai.Európai Urológiai Szövetség irányelvei a nem izom-invazív hólyagrákról (TaT1 és Carcinoma In Situ) -
2019-es frissítés.Eur Urol.2019;76, 639-57.
46. Aragon-Ching JB.Kihívások és előrelépések az uroteliális felső traktus és a hólyagrák diagnosztizálásában, biológiájában és kezelésében.Urol Oncol.2017;35, 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Cholangiocarcinoma – fejlődő fogalmak és terápiás stratégiák.Nat Rev Clin Oncol.2018;15, 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Folyékony biopszia hepatocellulárisban
carcinoma: keringő daganatsejtek és keringő tumor DNS.Mol Rák.2019;18:114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K és társai.Pánrák
keringő tumor DNS kimutatása több mint 10 000 kínai betegnél.Nat Commun.2021;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R, et al.Új válaszértékelési kritériumok szolid daganatokban: felülvizsgált RECIST irányelv (1.1-es verzió).Eur J Rák.2009;45, 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST – tanulni a múltból a jövő építéséhez.Nat Rev Clin Oncol.
2017;14, 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S és mások.iRECIST: iránymutatások a kísérletekben használható válaszkritériumokhoz
immunterápiás szerek tesztelése.Lancet Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Folyékony biopszia és minimális reziduális betegség – legújabb fejlesztések és a gyógyítás következményei.Nat Rev Clin Oncol.2019;16, 409-24 (1999)].
Idézd ezt a cikket: Qian C, Zou X, Li W, Li Y, Yu W. A rák elleni előőrs: univerzális rákjelzők.Cancer Biol Med.2023;20, 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Feladás időpontja: 2024. május 07